今日,又一项华人学者的研究登上了知名学术期刊的封面——中山大学中山医学院的信文君教授团队在最新一期的《Science Signaling》上发表论文,介绍了一条介导慢性疼痛的信号通路,并阐明了背后的关键生物学机制。这一研究有望带来全新的止疼方案。

▲信文君教授团队的研究荣登《Science Signaling》封面(图片来源:《Science Signaling》)
信文君教授的主要研究方向是突触的可塑性和痛觉的病理生理学。我们知道,痛觉的感知和神经元的突触活性息息相关,如果这些神经元过度兴奋,就会引起慢性疼痛,但背后的具体生物学机理却没有得到很好的阐明。

▲这项研究的作者是“全华班”(图片来源:《Science Signaling》)
在这项研究中,这支“全华班”团队首先将目光放在了痛觉领域内的一个经典发现——抗癌药物奥沙利铂(oxaliplatin)会导致显著的疼痛感知异常。由于δ-catenin蛋白的棕榈酰化修饰与疼痛相关神经元的突触可塑性相关,研究人员自然而然将这两者联系了起来。奥沙利铂是通过蛋白修饰,让患者产生异常疼痛的副作用吗?研究结果支持了这一点:在奥沙利铂的作用下,大脑DRG神经元的棕榈酰化修饰有明显上升;通过抑制这一蛋白修饰,我们也能减少奥沙利铂带来的异常疼痛。这些结果表明,δ-catenin蛋白的棕榈酰化修饰对于疼痛的感知是必不可少的。
作为一种常见的翻译后蛋白修饰,棕榈酰化能增加蛋白质的疏水性,帮助蛋白质与脂双层进行“交流”。而δ-catenin是一种细胞粘附蛋白,更多是在结构上起作用。它与痛觉感知之间,还差了一些关键的环节。为了找到最后的几块拼图,研究人员们做了一个筛选,检查δ-catenin与Nav(钠离子门控通道)的关系,后者参与介导了痛觉相关神经元的动作电位产生。利用免疫共沉淀的方法,研究人员们发现δ-catenin主要结合Nav1.6和Nav1.7,而Nav1.6的结合会受到棕榈酰化的影响。这一下子就将棕榈酰化与痛觉感知串到了一块儿。

▲本研究的通讯作者信文君教授(图片来源:中山大学中山医学院)
在通常情况下,Nav1.6主要存在于细胞质中。而当它需要起作用时,会被运输到神经元的细胞表面。充当起钠离子的通道。研究人员们也因此大胆推测,至少有一种参与细胞内运输的蛋白会与δ-catenin结合。同样是利用免疫共沉淀的方法,两款驱动蛋白KIF3A和KIF3B脱颖而出,显现了与δ-catenin结合的能力。
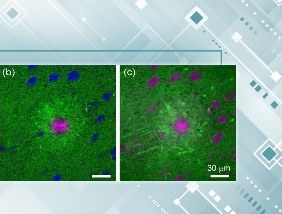
还记得上面提到的奥沙利铂吗?它有引起异常疼痛的副作用。而在小鼠中,奥沙利铂会显著增加δ-catenin与KIF3A的结合,这也暗示KIF3A在其中起到了主要作用。进一步的研究则表明,在神经疼痛的小鼠中,δ-catenin的棕榈酰化的确会促进KIF3A和Nav1.6在关键神经元里的结合,并让这三个蛋白形成一个复合体。
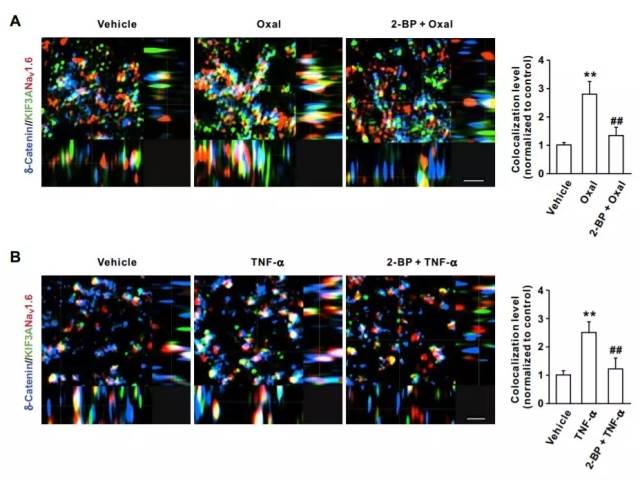
▲δ-catenin的棕榈酰化促进了蛋白复合体的形成(图片来源:《Science Signaling》)
研究人员们认为,这个蛋白复合体可能通过δ-catenin与KIF3A的帮助,让Nav1.6在神经元细胞膜表面的水平上升,从而让神经元对疼痛变得更为敏感。考虑生活在慢性疼痛之中的患者数量巨大,《Science Signaling》的短评中认为这一研究有望带来全新的成药靶点,造福人类。
我们再次祝贺信文君教授团队的研究荣登《Science Signaling》封面,并期待未来看到更多来自华人学者的杰出研究!
文章链接:
Xiao-Long Zhang, et al, "Palmitoylation of δ-catenin promotes kinesin-mediated membrane trafficking of Nav1.6 in sensory neurons to promote neuropathic pain," Sci. Signal. 27 Mar 2018:Vol. 11, Issue 523, eaar4394, DOI: 10.1126/scisignal.aar4394
(本文来源微信公众号:学术经纬。)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 中山大学
- 止疼疗法


 我要投稿
我要投稿