10月3日,清华大学生命科学学院王宏伟教授领导的研究组在《结构》(Structure) 期刊在线发表题为《利用球差矫正冷冻电镜和电压相位板技术在过焦状态下解析近原子分辨率蛋白结构》(Near-Atomic Resolution Structure Determination in Over-Focus with Volta Phase Plate by Cs-corrected Cryo-EM)的冷冻电镜方法学研究论文。该研究成果首次提出并使用过焦成像技术获得高分辨蛋白质结构,是冷冻电镜成像理论方面的新方法,同时也为球差矫正技术和相位板技术在生物冷冻电镜领域的应用提供了新思路。
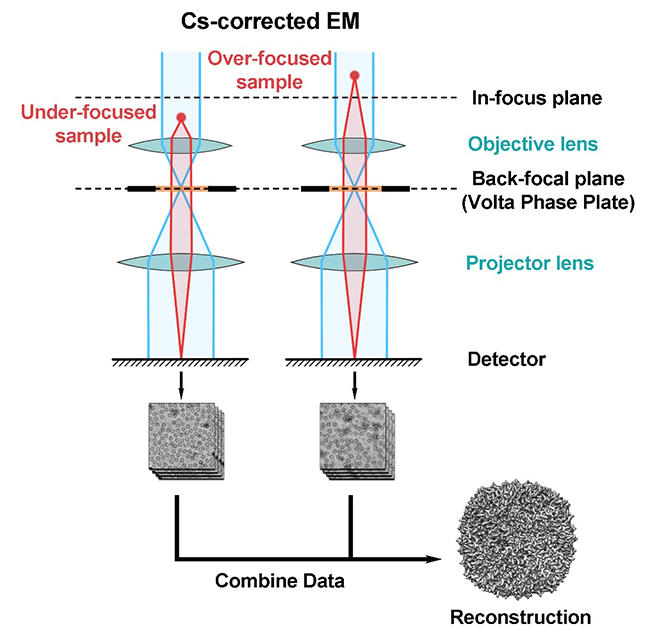
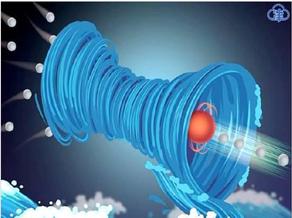
图:过焦成像技术示意图。
近年来,冷冻电镜技术的快速发展使得越来越多的生物大分子结构得以解析,但目前很多已发表的电镜结构在收集数据时的成像方式却仍在沿用数十年以前的欠焦成像方法。这是由于在电镜成像时,生物冷冻样品并不是完美的“弱相位物体”(即电子与其发生相互作用时只发生弹性散射而不损失能量),而是会受到一定的能量损失,产生振幅衬度。而根据衬度传递理论(Contrast transfer theory),在存在振幅衬度的情况下如果使用过焦成像,图像会在极低频率处有快速的相位反转,产生可以用肉眼观察到的图像衬度翻转(由黑变白)。而这种极低频的相位反转很难用软件去估测和校正,导致错误的高频信号相位拟合,造成无法获得高分辨的结构信息。
王宏伟实验室研究团队结合近几年发展起来的电压相位板(Volta phase plate,VPP)以及由材料电镜领域引入生物冷冻电镜的球差矫正器(Cs-corrector)技术,从理论上展示了在特定条件下可以利用这两个设备 使得收集的过焦数据和欠焦数据完全等价,从而不需要对过焦和欠焦数据进行区分。随后,研究人员利用电压相位板和球差矫正电镜收集了去铁蛋白(apo- ferritin)在欠焦和过焦状态下的电镜照片,并解析得到了去铁蛋白在欠焦状态下2.9埃、过焦状态下3.2埃和过焦/欠焦混合状态下3.0埃的三个 高分辨结构。这些结果从实验上证明了过焦成像技术的可行性,也为电镜数据收集提供了有价值的新特性。
清华大学生命科学学院教授、高精尖创新中心王宏伟博士和清华大学冷冻电镜平台主管雷建林博士为该论文的共同通讯作者。生命学院2014级博士生范潇,结构生物学高精尖创新中心卓越学者赵玲云博士为该论文共同第一作者。生命学院2014级博士生刘传参与了部分工作。北京大学化学院彭海琳课题组2014级博士生张金灿提供了石墨烯电镜载网,中国科学院生物物理研究所阎锡蕴课题组范克龙博士提供了去铁蛋白样品。
本项研究获得了清华大学冷冻电镜平台的大力支持,所有的冷冻电镜数据均采集于国家蛋白质科学(北京)设施清华大学冷冻电镜平台;数据处理工作获得了国家蛋白质科学(北京)设施清华大学高性能计算平台的支持。本项工作获得了国家自然科学基金委、科技部、北京市科委和北京市结构生物学高精尖创新中心等的支持。
文章链接:
Xiao Fan, et al, "Near-Atomic Resolution Structure Determination in Over-Focus with Volta Phase Plate by Cs-Corrected Cryo-EM," Structure, 2017, 25(10):1623-1630
(本文来源:清华大学新闻网;)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 清华大学
- 冷冻电镜


 我要投稿
我要投稿