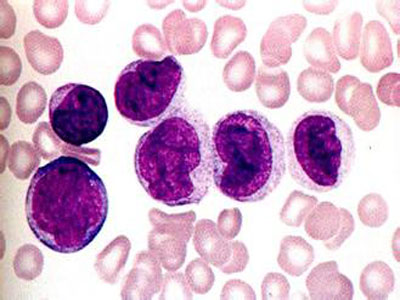
第28个“世界艾滋病日”前夕,南开大学医学院魏民教授课题组成功发现了一个新的人体宿主细胞编码的蛋白——卷曲螺旋结构蛋白8(以下简称CCDC8)。该蛋白具有很强的抗1型艾滋病病毒(HIV-1)活性。细胞水平表达CCDC8可以大幅度降低病毒产量,最大可达30倍降低。该蛋白的发现为“抗艾”药物的研制提供了全新靶点。日前,介绍该成果的论文在线发表于Nature出版集团旗下《Scientific Reports》杂志上。
近年来,尽管全球感染人数和因病致死人数持续下降,但艾滋病仍是世界性医学难题。人类至今没有发现彻底治愈艾滋病的疗法,而HIV病毒的多变性令疫苗研制工作举步维艰。目前,用于临床治疗的多种抗病毒药物在很大程度上能够缓解病人症状,延长患者生命。各类药物的主要原理就是抑制感染者体内HIV病毒的复制。
魏民团队长期致力于艾滋病研究工作。实验过程中,科研人员偶然发现人体细胞膜上的一种卷曲螺旋结构蛋白——CCDC8具有很强的抑制HIV病毒的活性。
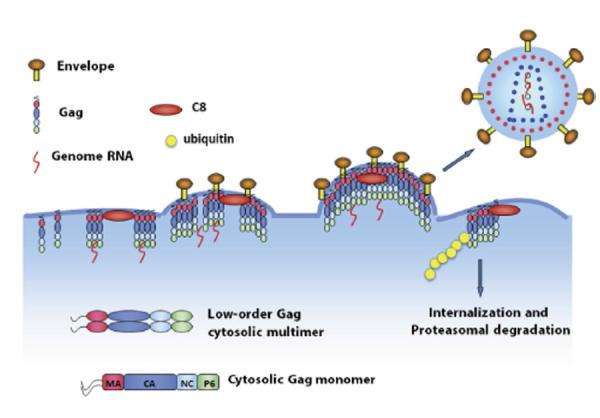
正常情况下,人体感染HIV病毒后,病毒会侵入人体细胞内部大量复制,然后释放到细胞外。其过程为,在病毒基因组“指导”下,宿主细胞会在细胞浆中合成一种名为“Gag”的结构蛋白。这种蛋白是构成HIV病毒骨架的主要“原料”。Gag蛋白会大量聚集到细胞膜上形成多聚体并向细胞外侧膨出,即“出芽”。随后,病毒“半成品”包裹一段病毒基因组脱离宿主细胞,最终形成一个完整的病毒颗粒。
科研人员在实验中发现,CCDC8能够改变HIV病毒的复制过程。当Gag蛋白在细胞膜上与CCDC8相遇后,其“组装”过程受到抑制。同时,CCDC8通过联合其他蛋白,如细胞骨架蛋白Obsl1和E3泛素连接酶Cul7,诱导Gag蛋白的内吞、多泛素化和降解。通俗来讲,构成HIV病毒骨架的Gag蛋白在CCDC8的作用下,不再向外“出芽”,而是被细胞“内吞”,进而被分解。这样,HIV病毒的复制就可以得到有效抑制,进而控制患者病情。
“CCDC8存在于正常的人体细胞膜上,只是量比较少,难以抑制HIV病毒复制。我们通过外源载体表达技术,提升了CCDC8的表达量之后,实验细胞的抗HIV病毒活性明显提升。我们有理由相信,CCDC8完全可以成为一个新的抗艾药物靶点。”魏民介绍,CCDC8诱导HIV-1 Gag的内吞、多泛素化和降解,这一机制在HIV-1研究的30多年过程中从未被发现,具有极大的新颖性。
“CCDC8的应用领域很广。它与HIV、肿瘤、3M综合症等疾病都有很大的关系。”魏民说,课题组将继续从事CCDC8功能、机理的研究。
鉴于此机制的新颖性和未来潜在的药物开发应用价值,该课题组已经申请了国家专利,并被国家知识产权局正式受理。
艾滋病,医学全名为“获得性免疫缺陷综合征”(Acquired Immune Deficiency Syndrome – AIDS)。它是由人类免疫缺陷病毒引起的。这种病毒终生传染,破坏免疫系统,使人体丧失抵抗各种疾病的能力。自1981年美国发现首例艾滋病病例之后,艾滋病在全球范围内迅速蔓延。最新数据显示,全球现有约3690万人感染艾滋病毒。近年来,在全球各国的努力下,新增感染人数不断下降。联合国会员国决定继续采取快速、有针对性的行动,以期在2030年前结束艾滋病流行。
论文链接:http://www.nature.com/articles/srep14724
魏民教授简介:
南开大学医学院教授,Email:weimin@nankai.edu.cn
本人自从2000年至今,一直从事艾滋病的研究工作,包括艾滋病病毒的分子流行病学、免疫学和病毒学等。具有十多年的经验,留学国外多年。目前,艾滋病已经导致世界上成千上万人的死亡,艾滋病依然没有彻底治愈的疗法。本课题组主要研究的方向包括:
1) 病毒与宿主细胞的相互关系。艾滋病病毒一方面利用宿主细胞的相关因子完成其复制生活周期,另一方面宿主细胞也产生相关因子去识别、拮抗病毒的复制。在前期的工作中,我们发现了一个新的宿主因子卷曲螺旋结构蛋白8(CCDC8)可以拮抗艾滋病病毒。其相关通路蛋白CCDC8-Obsl-Cul7可以诱导艾滋病病毒结构蛋白Gag的泛素化降解。其相关的机制以及意义正在研究中。
2) 2009年,德国医生为一位身患艾滋病和白血病的病人,进行了异体干细胞骨髓移植。骨髓移植的供者是CCR5Δ32缺失纯合子。CCR5为艾滋病毒进入人体细胞重要的辅助受体,CCR5Δ32位缺失为CCR5编码区第185位氨基酸后的32个碱基发生缺失。CCR5Δ32双等位基因纯合子缺失对艾滋病毒感染具有天然抗性。德国柏林病人骨髓移植后,停止抗病毒疗法,六年以后,病人依然没有病毒反弹。这是世界上第一个被认为“治愈”的艾滋病病人。然而,中国人群中CCR5Δ32缺失非常少,只有0-0.19%。由于异体骨髓移植的免疫排斥反应,以及供者稀少,寻找CCR5Δ32缺失纯合子对艾滋病人进行骨髓移植是不现实的。本研究试图使用最新一代的基因组编辑技术(CRISPR- Cas9技术,成簇的、规律间隔的短回文重复序列及相关蛋白)对人体干细胞进行体外诱导CCR5Δ32缺失,并且清除潜藏在人基因组中的艾滋病毒基因组,将改造后的干细胞自体回输给病人,以达到治疗艾滋病的目的。
荣誉与奖励:
1.2007年2月,十四届逆转录病毒与机会感染大会(14th Conference on Retroviruses and Opportunistic Infections),美国洛杉矶,青年研究人员奖(Young Investigator Award)
2.
2006年-
2008年,加拿大医学研究所(Canadian Institutes of Health
Research,CIHR)奖学金(Postdoctoral
Fellow Award),加元$40,000/年,加上$5000/年 会议费。
3. 2003年,中国疾病预防与控制中心,优秀博士论文
(本文整理自南开大学网站http://www.nankai.edu.cn/)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 南开大学
- 魏民
- 抗艾药物
- 全新靶点


 我要投稿
我要投稿