蛋白大分子的生物学功能与氨基酸链通过折叠形成的复杂三维结构密切相关。但是,有相当数目的蛋白分子,在行使 其功能时必须通过构型的变化才能实现。而这种单分子水平的变化过程复杂而迅速,因此对其内在物理机制的研究一直是这一领域重大挑战。近年来,有研究人员通 过分子拉伸形成的外力而诱导这一变化过程,使得相关研究取得了显著的进展。然而由于蛋白大分子的复杂多样性,对于构型变化从初始的延伸态转变成更为紧密结构的蛋白大分子(如PFO),分子拉伸的方法并不适用。
上海交大的研究团队在单分子纳米生物学中长期积累的优势为应对这一挑战展示了新的途径。研究人员首先发展了基于AFM的单分子压缩力谱技术,通过对扫描探针的精密控制而实现在单分子上施加可控的压缩力,从而诱导蛋白分子的构型变化。通过这样的方法,构型改变过程中的自由能景观(Free Energy landscape)等关键参数可以得到定量的解析,从而揭示其内在的物理原理。
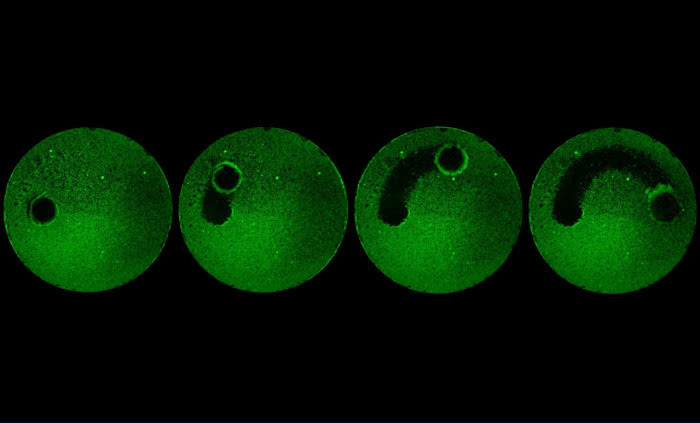
研究团队对具有重要生物医学意义的产气荚膜梭菌溶血素 (Perfringolysin O, PFO)的成孔过程进行了系统而定量的研究。PFO是由细菌产生的常见蛋白,可在细胞膜上形成孔道,导致细胞膜电位的崩溃及胞浆分子的流失,造成细胞死 亡,并最终导致大面积组织坏死。当PFO在细胞膜上形成纳米孔道时,其最关键的特征是从伸长的成孔前状态转变为缩紧的成孔状态,其变化达到40埃。
研究发现,如果对成孔前状态的PFO顶端施加一外力即可以诱导PFO进入成孔的构型,其过程满足单一势垒的二态模型。通过分子动力学模拟以及已知的相关结果,该 研究进一步发现,由PFO蛋白中与细胞膜作用的疏水区域可以产生足够的内力,起到与外力相同的效应,并导致PFO的构型改变。
这些结果不但为PFO构型变化提供了一个清晰的物理模型,还提出了分子内力在大分子内部的远距离传递新机制, 可以成为驱动蛋白大分子构型变化的关键因素。这一新机理对于其它具有类似变化的大分子研究亦有指导意义。同时,这一研究还指出了PFO中承担关键功能的氨 基酸,为药物探索提出了新的靶点。
文章链接:
D.M. Czajkowsky, et al, "Single molecule compression reveals intra-protein forces drive cytotoxin pore formation," eLIFE, DOI: http://dx.doi.org/10.7554/eLife.08421
D.M. Czajkowsky特别研究员简介:
上海交大生物医学工程学院特别研究员,博导,Email:dczaj@sjtu.edu.cn
个人主页:点击此处进入
研究领域:1) 蛋白质、DNA单分子生物物理研究;2) 临床前药物研发;3) 系统生物学与纳米技术仪器研发。
邵志峰教授简介:
上海交大生物医学工程学院教授,博导,千人计划教授,
Email:zfshao@sjtu.edu.cn
个人主页:点击此处进入
研究领域:生物物理学,功能基因组学,方法学创新和生物仪器研发
(本文整理自上海交通大学网站)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 上海交大
- 蛋白大分子
- 构型变化新机制


 我要投稿
我要投稿