10月7日,清华大学颜宁教授与德国德累斯顿工业大学Stephan Grill教授共同获得雷蒙德与比佛利赛克勒国际生物物理奖。颜宁的获奖理由为“对包括具有里程碑意义的人源葡萄糖转运蛋白GLUT1在内的关键膜蛋白的结构生物学研究做出突出贡献”
12月15日,今年的颁奖典礼在以色列特拉维夫大学举行。
除了摘得“赛克勒奖”外,今年早些时候,国际蛋白质学会(Protein Society)将2015年“青年科学家奖”授予了颜宁教授,表彰她在跨膜物质运输的结构生物学领域所做出的一系列杰出工作。颜宁博士是该奖设立27年来的第30位获奖者。
该学会指出,颜宁独立开展研究工作不到十年,但却在膜蛋白、特别是跨膜转运蛋白的结构生物学研究领域取得了一系列令人叹为观止的出色成果。此外,她在离子通道研究领域也卓有建树,为钠离子通道研究贡献了主要结构之一;她还利用最新冷冻电镜技术解析了高通量钙离子通道RyR1的高分辨率结构。
此外,6月26日,“科学中国人(2014)年度人物颁奖典礼”在北京举行,146位科学家荣膺科学中国人(2014)年度人物。基础研究领域共有16位科学家入选,其中包括了颜宁教授。
年初,颜宁在Nature发布新年寄语
2015年年初,Nature杂志邀请了几 位四十岁以下的科研新星来分享自己的新年计划和对未来的期许,颜宁教授就是其中之一。她说:“我们正处在结构生物学最好也是最坏的时代。我们结晶分子并用 X射线的衍射图谱来揭示它们的结构,而技术进步使冷冻电镜(cryo-EM)经历了一场革命。以往用结晶技术可能需要十年才能完成的困难项目,cryo- EM只需要半年就能解决。那么剩下那九年我们要做些什么呢?我对下一步的工作就有这样的焦虑。”
“大家一直在谈论着转化研究,但是回顾过去,革命总是出自于基础研究。我不希望人们问我‘你的研究能救命么?’,让人类获益是我们的一个宗旨,但基础研究实际上是在探索自然,了解自然是一件很酷的事。”

2015年,颜宁取得了哪些成果
颜宁教授自2007年10月回国组建实验室以来, 一直致力于结构生物学中最富挑战的领域之一、膜蛋白的结构与功能研究,并在8年内取得了一系列杰出成就。2014年,她率领的团队在世界上首次解析了人源 葡萄糖转运蛋白GLUT1的三维晶体结构,相关结果发布在顶级期刊《自然》杂志上。那么,今年颜宁教授又取得了哪些研究成果呢?
三项研究
Cell Research(3月13日)
Structure of the WD40 domain of SCAP from fission yeast reveals the molecular basis for SREBP recognition
3 月13日,发表在《细胞研究》(Cell Research)杂志上的一项研究中,来自清华大学、约翰霍普金斯大学医学院的研究人员报告称,他们重构出了裂殖酵母SREBP裂解激活蛋白 (SREBP cleavage-activating protein,SCAP) WD40结构域的晶体结构,通过分析这一结构揭示出了固醇调节元件结合蛋白(SREBP)识别的分子基础。
颜宁教授和约翰霍普金斯大学医学院的Peter Espenshade是这篇论文的共同通讯作者。在这篇文章中,研究人员报告称在体外重构出了Sre1 C-端结构域与Scp1复合物,以及Scp1的WD40结构域的晶体结构,分辨率达到2.1 Å。这一结构揭示出了一个八叶β-螺旋桨(eight-bladed β-propeller)部分,其显示出与经典WD40重复序列结构域不同的一些独特特征。结构及生物化学特征分析鉴别出了与Sre1识别有关的两个 Scp1元件。体内检测结果与这些结构和生物化学分析结果相一致。这些研究为了解SREBP识别机制提供了一个框架,并进一步确定了SREBP和SCAP 蛋白在裂殖酵母和高等生物中的功能特征。
Science(7月10日)
Crystal structure of a mycobacterial Insig homolog provides insight into how these sensors monitor sterol levels
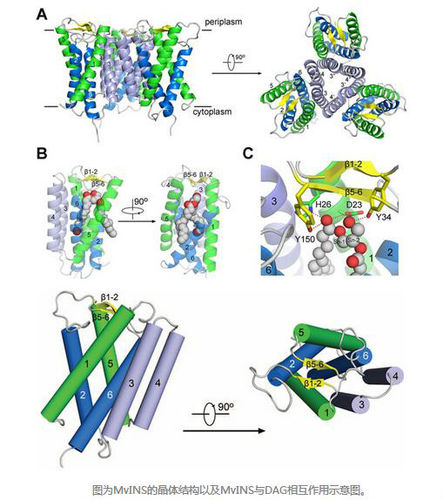
MvINS的晶体结构以及MvINS与DAG相互作用示意图
7 月10日,颜宁研究组在《科学》(Science)发表题为《分枝杆菌Insig同源蛋白晶体结构揭示Insig蛋白感受固醇的分子机制》 (Crystal structure of a mycobacterial Insig homolog provides insight into how these sensors monitor sterol levels)的研究论文,报道了一类分支杆菌中Insig同源蛋白MvINS的高分辨率晶体结构,并通过大量生化分析揭示了人源Insig蛋白感受调控 细胞内固醇类分子水平的生化机制。
在这篇文章中研究人员报告称,她们获得了高分辨率的分枝杆菌Insig同系物MvINS的 晶体结构。MvINS以一种同源三聚体(homotrimer)形式存在。每个原聚体都包含6个跨膜片段(TMs),TM3和TM4促成了同源三聚化。这 6个TMs围成了一个可以容纳一个甘油二酯分子的V形空腔。结合基于同源的人类Insig-2结构模型以及一些生化特征,表明Insig-2的中央空腔容 纳了25-羟胆固醇,而TM3和TM4参与了Scap结合。这些分析结果为进一步地了解Insig和SREBP信号通路的功能和机制提供了一个重要的框架。
Nature (7月15日)
Molecular basis of ligand recognition and transport by glucose transporters
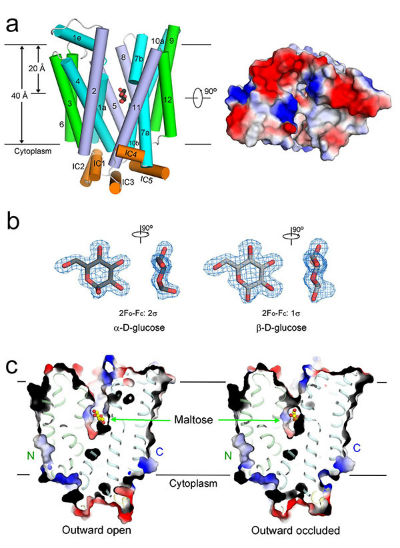
人源葡萄糖转运蛋白GLUT3处于不同状态的3个晶体结构
7 月15日,颜宁研究组在《自然》(Nature)在线发表题为《葡萄糖转运蛋白识别与转运底物的分子基础》(Molecular Basis of ligand recognition and transport by glucose transporters)的长文(Article),报道了人源葡萄糖转运蛋白GLUT3处于不同构象的3个高分辨率晶体结构,并通过与之前该组解析的 GLUT1的结构比对,完整揭示了葡萄糖转运蛋白底物识别与转运的分子机理,为基于结构的小分子设计提供了直接依据。
两篇综述
Annual Review of Biophysics(6月)
Structural Biology of the Major Facilitator Superfamily Transporters
今 年6月,颜宁教授在《Annual Review of Biophysics》杂志上发表了一篇题为“Structural Biology of the Major Facilitator Superfamily Transporters的综述文章,针对一个主要的次级膜转运蛋白超家族——主要协助转运蛋白超家族(MFS)的结构生物学进行了介绍。
Protein Science(12月9日)
“GLUT, SGLT, and SWEET: Structural and mechanistic investigations of the glucose transporters
12 月9日,颜宁教授与博士生邓东(Dong Deng)在《Protein Science》上发表了一篇题为“GLUT, SGLT, and SWEET: Structural and mechanistic investigations of the glucose transporters”的综述文章,介绍了近期有关葡萄糖转运蛋白的一些结构和机制研究进展,以及由这些结构获得的一些机制认识,包括底物识别、交替通路等的分子基础。
颜宁教授简介:
清华大学生命科学学院教授,博士生导师Email:structure@mail.tsinghua.edu.cn
主要科研领域与方向:
人类基因组中编码蛋白的所有基因约有30%编码膜蛋白(membrane
proteins)。膜蛋白在一切生命过程中起着关键作用,具有重要的生理功能。FDA批准上市的药物中,约50%的作用靶点为膜蛋白。因此,对膜蛋白结
构与功能的研究具有极高的生物学意义及医药应用前景。但是由于研究手段有限,对膜蛋白的生物学功能以及结构研究极为困难。
转运蛋白(transport proteins)是膜蛋白的一大类,介导生物膜内外的化学物质以及信号交换。脂质双分子层在细胞或细胞器周围形成了一道疏水屏障, 将其与周围环境隔绝起来。尽管有一些小分子可以直接渗透通过膜,但是大部分的亲水性化合物,如糖,氨基酸,离子,药物等等,都需要特异的转运蛋白的帮助来 通过疏水屏障。因此,转运蛋白在营养物质摄取,代谢产物释放以及信号转导等广泛的细胞活动中起着重要的作用。大量疾病都与膜转运蛋白功能失常有关,转运蛋 白是诸如抗抑郁剂,抗酸剂等大量药物的直接靶点。
我们的研究兴趣主要集中在次级主动运输蛋白(secondary active transporters)的工作机理上。交替通路模型(alternating-access model)被用来解释转运蛋白的工作机理,在这个模型中,转运蛋白至少采取两种构象来进行底物的装载及卸载:一种向膜外开放,一种向膜内开放。有许多结 构和生物物理学证据支持这个模型。但是,仍有两个最有趣的基本问题没有解决。第一,主动运输的能量偶联机制是什么?第二,在转运过程中,是什么因素触发了 转运蛋白的构象变化?我们实验室使用基于结构的研究手段对次级主动运输蛋白进行研究,以期解决转运蛋白工作机理中的基本问题。
(本文参考自生物探索网站http://www.biodiscover.com和清华大学网站http://www.tsinghua.edu.cn)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 清华大学
- 颜宁教授
- 赛克勒奖


 我要投稿
我要投稿








 赞 2
赞 2
 回复
回复






