图:清华大学施一公教授
清华新闻网7月22日电 7月22日,清华大学生命学院施一公教授研究组于《科学》杂志就剪接体的结构与机理研究发表两篇长文,题目分别为《酵母剪接体激活状态3.5埃的结构》和《第一步催化反应后的酵母剪接体3.4埃的结构》,报道了酿酒酵母剪接体激活和剪接反应催化过程中两个重要状态的剪接体复合物近原子分辨率的三维结构,阐明了剪接体的激活和催化机制,从而进一步揭示了前体信使RNA剪接反应(pre-mRNA splicing,以下简称RNA剪接)的分子机理。
RNA剪接是真核生物从DNA到蛋白质信息传递中心法则的关键一环。其主要执行者是一个极其复杂的分子机器——剪接体。通过剪接反应,前体信使RNA中数量、长度不等的内含子被剔除,剩下的外显子按照特异顺序连接起来从而形成成熟的信使RNA(mRNA),进一步在核糖体的催化下被翻译成蛋白质。RNA剪接的化学本质就是前体信使RNA经历两步转酯反应完成剪和接在两个关键步骤,而每一步都需要由剪接体催化完成。
剪接体是一个由大量蛋白因子介导、核酸(RNA)催化的金属核酶(protein-directed metalloribozyme)。在剪接反应过程中,组成剪接体的蛋白质-核酸复合物及剪接因子按照高度精确的顺序进行结合和解聚,并伴随大规模的结构重组,组装成一系列具有不同组分和构象的统称为剪接体的分子机器,根据它们在RNA剪接过程中的生化性质,这些剪接体又被人为区分为B、Bact、B*、C、P、ILS等若干状态。获取剪接体在激活及催化反应过程中不同状态的结构是最基础也是最富挑战性的结构生物学难题之一。2015年8月,施一公研究组率先突破,在世界上首次报道了裂殖酵母剪接体处于ILS状态的3.6埃高分辨率结构。
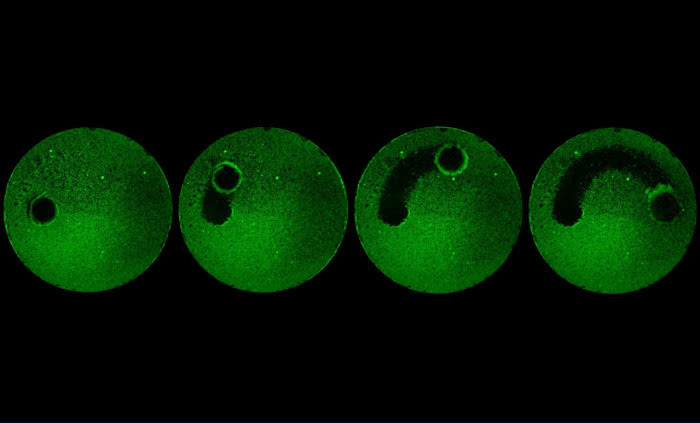
在最新发表的两篇《科学》论文中,施一公研究组进一步探索并优化了蛋白提纯方案,捕获了性质良好的酿酒酵母剪接体分别处于激活状态(activated spliceosome,又称为Bactcomplex)和第一步催化反应后(catalytic step I spliceosome,又称为C complex)的优质样品,并利用单颗粒冷冻电镜技术和高效的数据分类方法,重构出了总体分辨率分别为3.5和3.4埃的两个高分辨率冷冻电镜结构,并搭建了原子模型(图1,2)。这两个复合物近原子分辨率三维结构的解析,首次完整地展示了第一步转酯反应前后pre-mRNA和起催化作用的snRNA的反应状态,以及剪接体内部蛋白组分的组装情况。尤为值得一提的是,催化核心区域的分辨率达到了2.8至3.0埃,清晰的展示出剪接反应中心的结构信息,为解释剪接体对pre-mRNA splicing的催化机制提供了迄今最为清晰的关键证据。

如上两个结构与该研究组之前报道的ILS剪接体及2016年1月报道的3.8埃的酿酒酵母tri-snRNP结构的对比更为深刻的揭示了剪接体在pre-mRNA剪接反应过程中作为核酶催化完成两步转酯反应的本质,是RNA剪接研究领域的又一突破性进展。

图2 :C complex电镜密度及三维结构示意图。
清华大学医学院三年级博士生万蕊雪、生命学院博士后闫创业、生命学院一年级博士生白蕊为两篇文章的共同第一作者;生命学院一年级博士黄高兴宇为第二篇文章的共同第一作者;施一公教授为通讯作者。电镜数据采集于清华大学冷冻电镜平台,计算工作得到清华大学高性能计算平台、国家蛋白质设施实验技术中心(北京)、联想高性能计算、以及荣之联董事长王东辉先生的支持。本工作获得了北京结构生物学高精尖创新中心及国家自然科学基金委的经费支持。

图3:剪接反应机理图解
施一公教授简介:
施一公,国际著名的结构生物学家,清华大学教授。2013年12月19日,当选为中国科学院院士,2015年9月,出任清华大学副校长。业界称他是近30年来中国在基础生命科学领域,对世界科学做出了巨大贡献的科学家;他以结构生物学和生物化学的手段研究肿瘤发生和细胞凋亡的分子机制,用于治疗癌症的药物研发。
文章链接:
1. Yigong Shi, et al, "Structure of a yeast catalytically activated spliceosome at 3.5 Å resolution," Science, 2016
2. Yigong Shi, et al, "Structure of a yeast catalytic step I spliceosome at 3.4 Å resolution," Science, 2016
(本文转载自:清华大学网站;特别声明:本文转载仅仅处于传播信息的需要,如果作者不希望被转载,请联系我们!)
如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 清华大学


 我要投稿
我要投稿